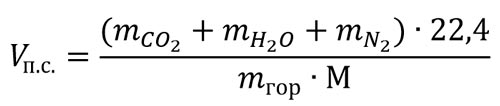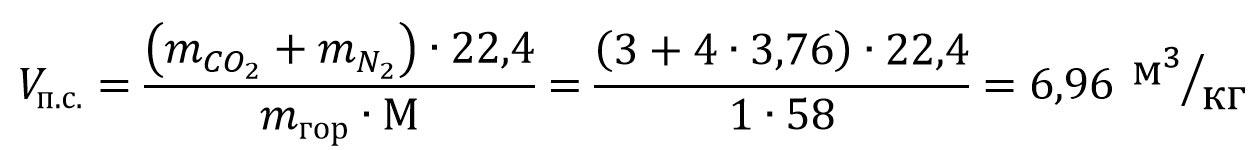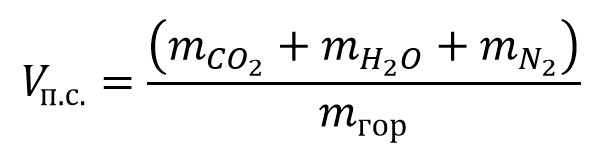Продукты горения – это вещества (газообразные, жидкие или твердые вещества) и соединения, образующиеся в результате сложного физико-химического процесса горения веществ (материалов).
Состав их зависит от состава горящего вещества и условий его горения. На пожарах чаще всего горят органические вещества (древесина, ткани, бензин, керосин, резина и др.), в состав которых входят углерод, водород, кислород, сера и азот. В зависимости от условий их горения могут образовываться продукты полного и неполного сгорания.
К продуктам полного сгорания относятся углекислый газ, сернистый газ, пары воды, азот (при сгорании азотсодержащих соединений). Все они не способны гореть и не поддерживают горение большинства горючих веществ.
При горении в недостаточном количестве воздуха или при низкой температуре кроме продуктов полного сгорания образуются продукты неполного сгорания: окись углерода, сажа и продукты термоокислительного разложения.
Продукты сгорания многих органических и неорганических веществ содержат взвешенные твердые частицы (сажа, окислы, соли и др.). Такая дисперсная система называется дымом.
Знание свойств и количества продуктов горения необходимо для расчета теплоты сгорания, температуры горения и других показателей, используемых для оценки пожаровзрывоопасности веществ (материалов), объектов с наличием этих веществ (материалов).
Состав
Продукты сгорания называют влажными, если при расчете их состава учитывают содержание паров воды, и сухими, если содержание паров воды не входит в расчетные формулы.
Реже во время пожара горят неорганические вещества, такие как сера, фосфор, натрий, калий, кальций, алюминий, титан, магний и др. Продуктами сгорания их в большинстве случаев являются твердые вещества, например Р2О5, Na2O2, CaO, MgO. Образуются они в дисперсном состоянии, поэтому поднимаются в воздух в виде плотного дыма. Продукты сгорания алюминия, титана и других металлов в процессе горения находятся в расплавленном состоянии.
При неполном сгорании органических веществ в условиях низких температур и недостатка воздуха образуются более разнообразные продукты – окись углерода, спирты, кетоны, альдегиды, кислоты и другие сложные химические соединения. Они получаются при частичном окислении как самого горючего, так и продуктов его сухой перегонки (пиролиза). Эти продукты образуют едкий и ядовитый дым. Кроме того, продукты неполного горения сами способны гореть и образовывать с воздухом взрывчатые смеси. Такие взрывы бывают при тушении пожаров в подвалах, сушилках и в закрытых помещениях с большим количеством горючего материала. Рассмотрим кратко свойства основных продуктов горения.
Углекислый газ
Углекислый газ или двуокись углерода (СО2) – продукт полного горения углерода. Не имеет запаха и цвета. Плотность его по отношению к воздуху равна 1,52. Плотность углекислого газа при температуре Т = 0 °С и при нормальном давлении р = 760 миллиметров ртутного столба (мм Hg) равна 1,96 кг/м3 (плотность воздуха при этих же условиях равна ρ = 1,29 кг/м3). Углекислый газ хорошо растворим в воде (при Т = 15 °С в одном литре воды растворяется один литр газа). Углекислый газ не поддерживает горение веществ, за исключением щелочных и щелочно-земельных металлов. Горение магния, например, происходит в атмосфере углекислого газа по уравнению:
CO2 +2 Mg = C + 2 MgO.
Токсичность углекислого газа незначительна. Концентрация углекислого газа в воздухе 1,5 % безвредна для человека длительное время. При концентрации углекислого газа в воздухе, превышающей 3-4,5 %, нахождение в помещении и вдыхание газа в течение получаса опасно для жизни. При температуре Т = 0 °С и давлении р = 3,6 МПа углекислый газ переходит в жидкое состояние. Температура кипения жидкой углекислоты составляет Т = –78 °С. При быстром испарении жидкой углекислоты газ охлаждается и переходит в твердое состояние. Как в жидком, так и твердом состоянии, капли и порошки углекислоты применяются для тушения пожаров.
Оксид углерода
Оксид углерода или угарный газ (СО) – продукт неполного сгорания углерода. Этот газ не имеет запаха и цвета, поэтому особо опасен. Относительная плотность равна 0,97. Плотность угарного газа при Т = 0 °С и р = 760 мм Hg составляет 1,25 кг/м3. Этот газ легче воздуха и скапливается в верхней части помещения при пожарах. В воде оксид углерода почти не растворяется. Способен гореть и с воздухом образует взрывчатые смеси. Угарный газ при горении дает пламя синего цвета. Угарный газ является очень токсичным. Вдыхание воздуха с концентрацией угарного газа 0,4 % смертельно для человека. Стандартные противогазы от угарного газа не защищают, поэтому при пожарах применяются специальные фильтры или кислородные изолирующие приборы.
Вода
Всем известная вода – Н2О – также выделяется во время горения виде газа – как пар. Вода является продуктом горения газа метана – СН4. Вообще, вода и углекислота в основном выделяются при полном сгорании всех органических веществ.
Цианистый водород
Цианистый калий – сильнейший яд – соль синильной кислоты, также известной как цианистый водород – HCN. Это бесцветная жидкость, но очень летучая (легко переходящая в газообразное состояние). То есть при горении она тоже будет выделяться в атмосферу в виде газа. Синильная кислота очень ядовита, даже небольшая – 0,01 процент – концентрация в воздухе приводит к летальному исходу. Отличительной чертой кислоты является характерный запах горького миндаля. Но синильной кислоте присуща одна «изюминка» – отравиться ей можно, не только вдыхая непосредственно органами дыхания, но и через кожу. Так что защититься только средствами индивидуальной защиты органов дыхания и зрения не получится.
Акролеин
Пропеналь, акролеин, акрилальдегид – все это названия одного вещества, ненасыщенного альдегида акриловой кислоты: СН2=СН-СНО. Этот альдегид тоже является сильно летучей жидкостью. Акролеин бесцветен, с резким запахом, очень ядовит. При попадании жидкости или ее паров на слизистые, особенно в глаза, вызывает сильное раздражение. Пропеналь является высокореакционным соединением, и это объясняет его высокую токсичность.
Формальдегид
Подобно акролеину, формальдегид принадлежит к классу альдегидов и является альдегидом муравьиной кислоты. Также это соединение известно как метаналь. Это токсичный, бесцветный газ с резким запахом.
Азотсодержащие вещества
Чаще всего во время горения веществ, содержащих азот, выделяется чистый азот – N2. Этот газ и так содержится в атмосфере в большом количестве. Азот может быть примером продукта горения аминов. Но при термическом разложении, к примеру, солей аммония, а в некоторых случаях и при самом горении, в атмосферу выбрасываются и его оксиды, со степенью окисления азота в них плюс один, два, три, четыре, пять. Оксиды – газы, имеют бурый цвет и чрезвычайно токсичны.
Сернистый газ
Сернистый газ (SO2) – продукт горения серы и сернистых соединений. Бесцветный газ с характерным резким запахом. Относительная плотность сернистого газа равна 2,25. Плотность этого газа при Т = 0 °С и р = 760 мм Hg составляет 2,9 кг/м3, то есть он намного тяжелее воздуха. Сернистый газ хорошо растворяется в воде, например, при температуре Т = 0 °С в одном литре воды растворяется восемьдесят литров SO2, а при Т = 20 °С – сорок литров. Сернистый газ горение не поддерживает. Действует раздражающим образом на слизистые оболочки дыхательных путей, вследствие чего является очень токсичным.
Дым
При горении многих веществ, кроме рассмотренных выше продуктов сгорания выделяется дым – дисперсная система, состоящая из мельчайших твердых частиц, находящихся во взвешенном состоянии в каком-либо газе. Диаметр частиц дыма составляет от 10−4 до 10−6 см (от 1 до 0,01 мкм). Отметим, что 1 мкм (микрон) равен 10−6 м или 10−4 см. Более крупные твердые частицы, образующиеся при горении, быстро оседают в виде копоти и сажи. При горении органических веществ дым содержит твердые частицы сажи, взвешенные в CO2, CO, N2, SO2 и других газах. В зависимости от состава и условий горения вещества получаются различные по составу и по цвету дымы. При горении дерева, например, образуется серовато-черный дым, ткани – бурый дым, нефтепродуктов – черный дым, фосфора – белый дым, бумаги, соломы – беловато-желтый дым.
В составе дыма, образующегося на пожарах при горении органических веществ, кроме продуктов полного и неполного сгорания, содержатся продукты термоокислительного разложения горючих веществ. Образуются они при нагреве еще негорящих горючих веществ, находящихся в среде воздуха или дыма, содержащего кислород. Обычно это происходит перед факелом пламени или в верхних частях помещений, где находятся нагретые продукты сгорания.
Состав продуктов термоокислительного разложения зависит от природы горючих веществ, температуры и условий контакта с окислителем. Так, исследования показывают, что при термоокислительном разложении горючих веществ, в молекулах которых содержатся гидроксильные группы, всегда образуется вода. Если в составе горючих веществ находятся углерод, водород и кислород, продуктами термоокислительного разложения чаще всего являются углеводороды, спирты, альдегиды, кетоны и органические кислоты. Если в составе горючих веществ, кроме перечисленных элементов, есть хлор или азот, то в дыме находятся также хлористый и цианистый водород, оксиды азота и другие соединения. Так, в дыме при горении капрона содержится цианистый водород, при горении линолеума «Релин» – сероводород, диоксид серы, при горении органического стекла – оксиды азота. Продукты неполного сгорания и термоокислительного разложения в большинстве случаев являются токсичными веществами, поэтому тушение пожаров в помещениях производят только в кислородных изолирующих противогазах.
Пепел, зола, копоть, сажа, уголь
Копоть, или сажа – остатки углерода, который не вступил в реакцию, по разным причинам. Сажу называют также амфотерным углеродом. Зола, или пепел – мелкие частицы неорганических солей, не сгоревших или не разложившихся при температуре горения. При выгорании топлива эти микросоединения переходят во взвешенное состояние или скапливаются внизу. А уголь – это продукт неполного сгорания дерева, то есть не сгоревшие его остатки, но при этом еще способные гореть. Конечно, это далеко не все соединения, которые выделятся при сгорании тех или иных веществ. Перечислить их всех нереально, да и не нужно, потому что другие вещества выделяются в ничтожно малых количествах, и только при окислении определенных соединений.
Классификация
Большинство продуктов горения являются отравляющими веществами. Поэтому, говоря об их классификации, будет правильным ознакомить вас со следующим термином:
Классификация опасности веществ по степени воздействия на организм – это установление (ранжирование) уровней опасности веществ по их поражающему и повреждающему воздействию на организм человека и (или) животного. Более подробно о данной классификации читайте в материале по ссылке >>
Также ознакомьтесь с познавательным материалом по теме:
Показатель токсичности продуктов горения
Формулы для расчета объема
Вид формулы для расчета объема продуктов полного сгорания при теоретически необходимом количестве воздуха зависит от состава горючего вещества.
Индивидуальное химическое соединение
В этом случае расчет ведут, исходя из уравнения реакции горения. Объем влажных продуктов сгорания единицы массы (кг) горючего вещества при нормальных условиях рассчитывают по формуле:
где:
Vп.с. – объем влажных продуктов сгорания, м3/кг; ![]() – число киломолей диоксида углерода, паров воды, азота и горючего вещества в уравнении реакции горения; М – масса горючего вещества, численно равная молекулярной массе, кг.
– число киломолей диоксида углерода, паров воды, азота и горючего вещества в уравнении реакции горения; М – масса горючего вещества, численно равная молекулярной массе, кг.
Например, чтобы определить объем сухих продуктов сгорания 1 кг ацетона при нормальных условиях, составляем уравнение реакции горения ацетона в воздухе:
CH3COCH3 + 4O2 + 4·3,76N2 = 3CO2 + 3H2O + 4·3,76N2
Определяем объем сухих продуктов сгорания ацетона:
Объем влажных продуктов сгорания 1 м3 горючего вещества (газа) можно рассчитать по формуле:
где:
Vп.с. – объем влажных продуктов сгорания 1 м3 горючего газа, м3/м3; ![]() – число молей диоксида углерода, паров воды, азота и горючего вещества (газа).
– число молей диоксида углерода, паров воды, азота и горючего вещества (газа).
Сложная смесь химических соединений
Если известен элементный состав сложного горючего вещества, то состав и количество продуктов сгорания 1 кг вещества можно определить по уравнению реакции горения отдельных элементов. Для этого составляют уравнения реакции горения углерода, водорода, серы и определяют объем продуктов сгорания, приходящийся на 1 кг горючего вещества. Уравнение реакции горения имеет вид:
С + О2 + 3,76N2 = СО2 + 3,76N2
При сгорании 1 кг углерода получается 22,4 / 12 = 1,86 м3 СО2 и 22,4 × 3,76/12 = 7,0 м3 N2.
Аналогично определяют объем (в м3) продуктов сгорания 1 кг серы и водорода. Полученные данные приведены ниже:
| СО2 | N2 | Н2О | SO2 | |
| Углерод | 1,86 | 7,00 | – | – |
| Водород | – | 21,00 | 11,2 | – |
| Сера | – | 2,63 | – | 0,7 |
При горении углерода, водорода и серы кислород поступает из воздуха. Однако в состав горючего вещества может входить кислород, который также принимает участие в горении. В этом случае воздуха на горение вещества расходуется соответственно меньше.
В составе горючего вещества могут находиться азот и влага, которые в процессе горения переходят в продукты сгорания. Для их учета необходимо знать объем 1 кг азота и паров воды при нормальных условиях.
Объем 1 кг азота равен 0,8 м3, а паров воды 1,24 м3. В воздухе при 0 °С и давлении 101325 Па на 1 кг кислорода приходится 3,76 × 22,4 / 32 = 2,63 м3 азота.
На основании приведенных данных определяют состав и объем продуктов сгорания 1 кг горючего вещества.
Например, чтобы определить объем и состав влажных продуктов сгорания 1 кг каменного угля, состоящего из 75,8 % С, 3,8 % Н, 2,8 % О, 1,1 % N, 2,5 % S, W = 3,8 %, A = 11,0 %.
Объем продуктов сгорания будет следующий, м3:
| Состав продуктов сгорания | СО2 | Н2О | N2 | SO2 |
| Углерод | 1,86 × 0,758 = 1,4 | – | 7 × 0,758 = 5,306 | – |
| Водород | – | 11,2 × 0,038 = 0,425 | 21 × 0,038 = 0,798 | – |
| Сера | – | – | 2,63 × 0,025 = 0,658 | 0,7 × 0,025 = 0,017 |
| Азот в горючем веществе | – | – | 0,8 × 0,011 = 0,0088 | – |
| Влага в горючем веществе | – | 1,24 × 0,03 = 0,037 | – | – |
| Сумма | 1,4 | 0,462 | 6,7708 – 0,0736 = 6,6972 | 0,017 |
Из общего объема азота вычитают объем азота, приходящийся на кислород в составе каменного угля 0,028 × 2,63 = 0,0736 м3. Итог указывает состав продуктов сгорания каменного угля: объем влажных продуктов сгорания 1 кг каменного угля равен:
Vп.с. = 1,4 + 0,462 + 6,6972 + 0,017 = 8,576 м3/кг.
Смесь газов
Количество и состав продуктов сгорания для смеси газов определяют по уравнению реакции горения компонентов, составляющих смесь. Например, горение метана протекает по следующему уравнению:
СН4 + 2О2 + 2 × 3,76N2 = СО2 + 2Н2О + 7,52N2
Согласно этому уравнению, при сгорании 1 м3 метана получается 1 м3 диоксида углерода, 2 м3 паров воды и 7,52 м3 азота. Аналогично определяют объем (в м3) продуктов сгорания 1 м3 различных газов:
| СО2 | Н2О | N2 | SO2 | |
| Водород | – | 1,0 | 1,88 | – |
| Окись углерода | 1,0 | – | 1,88 | – |
| Сероводород | – | 1,0 | 5,64 | 1,0 |
| Метан | 1,0 | 2,0 | 7,52 | – |
| Ацетилен | 2,0 | 1,0 | 9,54 | – |
| Этилен | 2,0 | 2,0 | 11,28 | – |
На основании приведенных цифр определяют состав и количество продуктов сгорания смеси газов.
Анализ продуктов сгорания, взятых на пожарах в различных помещениях, показывает, что в них всегда содержится значительное количество кислорода. Если пожар возникает в помещении с закрытыми оконными и дверными проемами, то пожар при наличии горючего может продолжаться до тех пор, пока содержание кислорода в смеси воздуха с продуктами сгорания в помещении не снизится до 14-16 % (об.). Следовательно, на пожарах в закрытых помещениях содержание кислорода в продуктах сгорания может быть в пределах от 21 до 14 % (об.). Состав продуктов сгорания во время пожаров в помещениях с открытыми проемами (подвал, чердак) показывает, что содержание в них кислорода может быть ниже 14 % (об.):
| СО | СО2 | О2 | |
| В подвалах | 0,15-0,5 | 0,8-8,5 | 10,6-19 |
| На чердаках | 0,1-0,6 | 0,3-4,0 | 16,0-20,2 |
По содержанию кислорода в продуктах сгорания на пожарах можно судить о коэффициенте избытка воздуха, при котором происходило горение.
Действие на организм человека
Степень токсичности веществ связана с их физической и химической природой. Взаимодействуя с организмом, продукты горения вызывают патологические синдромы.
Международная классификация болезней десятого пересмотра МКБ-10 определяет отравление продуктами горения кодом Т59 – «Токсическое действие других газов, дымов и паров».
По механизму действия на человека отравляющие компоненты в составе дыма делятся на пять групп.
- Вещества, которые вызывают поражение кожного покрова и слизистой оболочки. Симптомы такого отравления продуктами горения – зуд, жжение кожи и её воспаление, боль в области глаз, век, слезотечение, кашель. Примеры – пары дёгтя, сернистый газ, формальдегид.
- Продукты горения, которые вызывают острые ингаляционные отравления. Пострадавшие жалуются на одышку, кашель. При осмотре обращает на себя внимание частое дыхание, синюшность. При высокой концентрации токсичного газа может произойти остановка дыхания. Так, признаки отравления продуктами горения ПВХ могут проявиться через несколько часов. Ингаляционные отравления вызывает хлор, аммиак, оксид азота.
- Продукты горения с образованием токсичных веществ, которых называют «ядами крови». Связывая гемоглобин, они нарушают доступ кислорода к тканям и запускают патологические реакции, охватывающие весь организм. Примеры – угарный газ, диоксид азота.
- Продукты горения, для которых органом-мишенью является нервная система. Это бензол, сероводород.
- Ферментные яды, которые воздействуют на тканевое дыхание, блокируя процессы активации кислорода. Это сероводород, синильная кислота.
Многие токсины, образующие в продуктах горения «универсальны», так как вызывают поражение сразу нескольких систем организма.
Первая помощь при отравлении
Симптомы интоксикации разными веществами могут отличаться, но принципы оказания первой помощи всегда одинаковые.
Большинство ядов поступает через дыхательные пути. Первое, что необходимо сделать при отравлении – прекратить поступление продуктов горения в организм. Для этого необходимо:
- соблюдая безопасность и если имеется такая возможность прекратить поступление токсичного вещества – газа, дыма;
- проветрить помещение или иной объем где находится пострадавший;
- снять загрязнённую одежду;
- при отсутствии противопоказаний перенести пострадавшего в безопасное место.
Острая интоксикация требуют оказания экстренной помощи. Действия при отравлении продуктами горения, следующие:
- вызвать «скорую помощь»;
- при задымлении предусмотреть способы защиты органов дыхания от продуктов горения;
- если есть симптомы раздражения – промыть глаза, полость рта, носа;
- при отсутствии сознания придать пострадавшему горизонтальное положение и обеспечить проходимость дыхательных путей;
- до приезда медицинских специалистов наблюдать за сознанием, дыханием, частотой сердечных сокращений, артериальным давлением;
- если есть признаки терминального состояния, то приступить к сердечно-лёгочной реанимации.
Некоторые ингаляционные отравления продуктами горения имеют период мнимого благополучия. Даже при отсутствии патологических симптомов, стоит внимательно следить за состоянием тех, кто может быть отравлен. При первых же признаках неблагополучия необходимо вызывать соответствующих специалистов.
Отравление продуктами горения у детей развивается быстрее, чем у взрослых. Это объясняется более высоким уровнем кислородного обмена. У малышей появляются жалобы на головную боль, сонливость, слезотечение, тошноту. При осмотре заметны изменения цвета кожи, учащение и затруднение дыхания, нарушения координации. Принципы оказания первой помощи для детей те же, что и для взрослых. При отсутствии специализированной медицинской помощи, пострадавшему ребенку угрожают необратимые изменения центральной нервной системы.
Источник: Пожаровзрывобезопасность веществ и материалов и средства их тушения: Справочник. Баратов А.Н., Корольченко А.Я. –М., 1990.